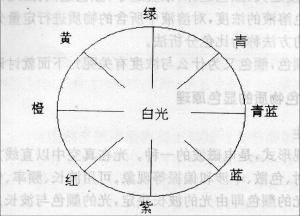
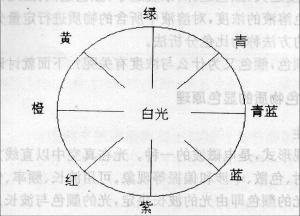
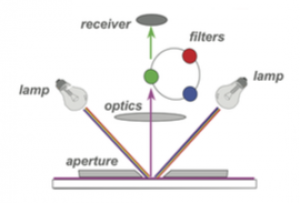
分光光度法的实验原理是物质与光作用,具有选择吸收的特性。有色物质的颜色是该物质与光作用产生的。即有色溶液所呈现的颜色是由于溶液中的物质对光的选择性吸收所致。
由于不同的物质其分子结构不同,对不同波长光的吸收能力也不同,因此具有特征结构的结构集团,存在选择吸收特性的最大实收波长,形成最大吸收峰,而产生特有的吸收光谱。即使是相同的物质由于其含量不同,对光的吸收程度也不同。
分光光度法利用物质所特有的吸收光谱来鉴别物质的存在(定性分析),或利用物质对一定波长光的吸收程度来测定物质含量(定量分析)。
分光光度法的实验原理是:
1、光度法测定的条件:分光光度法测定物质含量时应注意的条件主要是显色反应的条件和测定吸光度的条件。显色反应的条件有显色剂的用量,介质的酸度、显色时温度、显色时间及干扰物质的消除方法等;测量吸光度的条件包括入射光波长的选择、吸光度范围和参比溶液等。
2、二氮杂菲-亚铁络合物:邻二氮杂菲是测定微量铁的一种较好的试剂。在pH=2~9的条件下Fe2+离子与邻二氮杂菲生成稳定的橘红色络合物,此络合物的lgK稳=21.3,摩尔吸光系数ε510=1.1×104 在显色前,首先用盐酸羟胺把Fe3+离子还原为Fe2+离子,其反应式如下:
2Fe3++2NH2OH·HCl→2Fe2++N2+2H2O+4H++2Cl-
测定时,控制溶液酸度在pH=5左右较为适宜。酸度过高,反应进行较慢;酸度太低,则Fe2+离子水解,影响显色。
Bi3+,Cd2+,Hg2+,Ag+,Zn2+等离子与显色剂生成沉淀,Ca2+,Cu2+,Ni2+等离子与显色剂形成有色络合物。
因此当这些离子共存时,应注意它们的干扰作用。






 时间:2022-11-07
时间:2022-11-07  浏览量: 1926
浏览量: 1926  上一页 :
上一页 :